热工基础理论,热力学基础热力学基础:从热工基础理论到实践应用
1、理想气体状态方程式 理想气体的状态方程式可表示为对于质量为m的气体
pe =Rr
pV= mRT
R= 8314.3M式中
p——绝对压力(Pa);
v——比体积(m3/kg);
R—气体常数[J/(kg·K)];
M——气体的摩尔质量(kg/mol);
V——气体所占体积(m3);
T——热力学温度(K)。
制冷工程中遇到的各种气体(如空气、氮气)及远离液态的相对低压、高温的氨或卤代烃蒸气等,均可视为理想气体。
2、热力学第一定律
热力学第一定律就是能量守恒和互换定律在热与功方面的转换关系,即在任何发生能量转 换的热力过程中,转换前后能量的总量维持恒定。它是人封闭系统 们在长期的实践过程中总结出来的,它否定了第一类永动 机的可能性,即任何动力机械都需要耗能的。
1.热力学第一定律在封闭系统中的表示 图2-1所示为一封闭系统,如系统中有mkg工质,则 对单位质量工质的热力学第一定律表达式为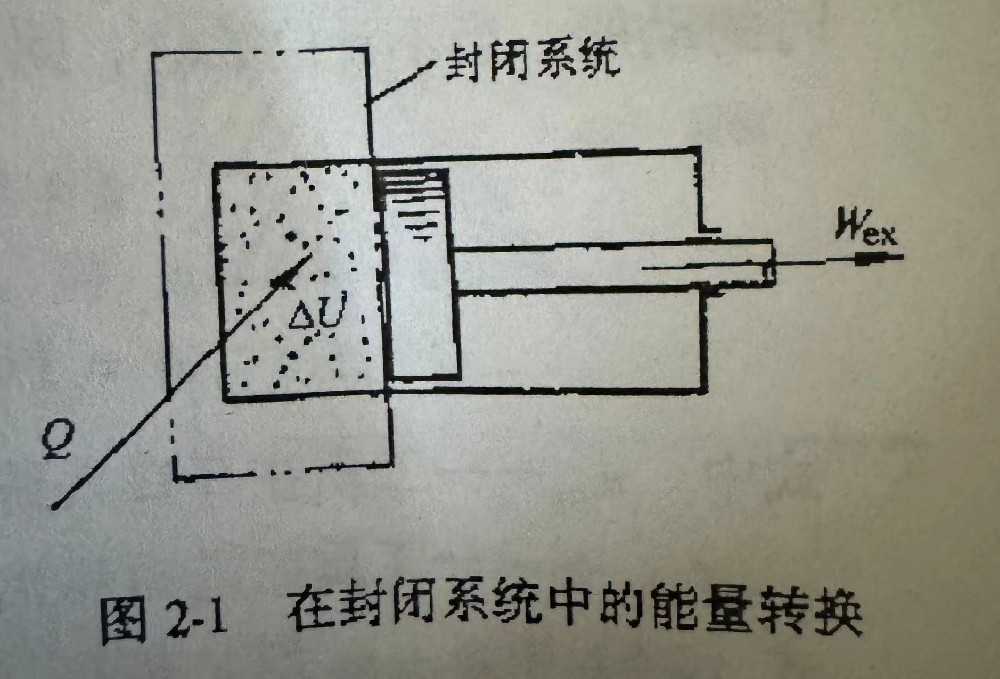 q=△u+wex
q=△u+wex
(2-3)
图2-1在封闭系统中的能量转换
式中国 q——外界加给系统中单位质量工质的热量(J/kg);
△u——系统中单位质量工质的热力学能的增量(J/kg);
10——系统中单位质量工质对外界作的膨胀功(J/kg)。
必须指出;热量与功都是能量的不同型式,当物体与外界存在温差时,发生的能量传递就 是热量;当物体在空间中由于体积、形状和位置变化,与外界发生的能量交换就是功。所以热 与功只发生在物体与外界相互作用的过程中,它们量的大小决定于物体变化过程的性质。所
以,不能说工质在每一状态下含有多少热和功。工质的热力学能以U表示,单位质量工质的
热力学能以u表示,称为“比热力学能(比内能)”,比热力学能也是状态参数。在式(2-3) 中规定外界对工质加热时q为正,而工质对外界放热时q为负,同样工质在状态变化过程中



热工基础理论的意义:为热力学领域的发展提供指引以上文章来自沈阳冷水机组回收网http://www.shoukongtiao.com热力学基础:解读热工基础理论的核心要点。


 客服1
客服1